- Laboratório
- Medicina laboratorial
- Reagente de resina
- G-BIOSCIENCES
Reagente de resina 786-285para pesquisade proteínasde densidade
Guardar nos favoritos
Comparar
Características
- Tipo
- de resina
- Aplicações
- para pesquisa
- Marcador testado
- de proteínas, de densidade, de metais, de cobre, de zinco
Descrição
A cromatografia de afinidade de iões metálicos imobilizados (IMAC), desenvolvida por Porath et al (1), baseia-se na interação de certos resíduos de proteínas (histidinas, cisteínas e, em certa medida, triptofanos) com catiões de metais de transição. A Resina Quelante de Cobre foi especificamente concebida para a purificação de proteínas que se associam a iões de cobre (2-3), incluindo proteínas marcadas com histidina 6x.
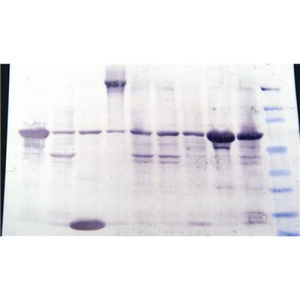
Resina de cromatografia de afinidade de metais imobilizada (IMAC) que utiliza cobre (Cu2+) para a purificação de proteínas marcadas com 6x histidina.
Esta resina liga-se a seis resíduos de histidina (6x His), uma etiqueta comum utilizada na purificação de proteínas. A resina é constituída por iminodiacetato acoplado a esferas de agarose reticuladas a 6%. O iminodiacetato liga iões de cobre divalentes com uma capacidade de 20-40μmoles Cu2+/ml de resina. A capacidade de ligação de proteínas é >50mg de proteína por ml de resina. Demonstrámos a ligação de >100mg de proteínas marcadas com 50kDa 6XHis a um ml de resina.
Também estão disponíveis resinas quelantes de níquel, cobalto e zinco imobilizadas. O cobalto tem a maior seletividade, seguido do zinco, do níquel e do cobre, mas tem a menor capacidade de carga. O cobre tem a capacidade de carga mais elevada, seguido do níquel e do zinco.
Estão disponíveis tampões específicos de ligação/lavagem e eluição.
Características
Para a purificação de proteínas de ligação ao cobre, incluindo proteínas 6x His
Elevada capacidade: >50mg/ml
Densidade do ligando: 20-40μmoles Cu2+ /ml de resina
Estrutura do grânulo: agarose reticulada a 6%
Aplicações
Purificação por afinidade de proteínas de ligação ao cobre
Purificação por afinidade de proteínas com uma etiqueta His 6x.
---
Catálogos
Não estão disponíveis catálogos para este produto.
Ver todos os catálogos da G-BIOSCIENCESPesquisas relacionadas
- Kit de reagentes
- Kit de teste
- Kit de reagentes em solução
- Kit de reagentes para biologia molecular
- Kit de reagentes líquido
- Kit de reagentes para pesquisa
- Kit de reagentes de proteínas
- Kit de reagentes de laboratório
- Reagente com enzimas
- Kit de reagentes para histologia
- Kit de teste óptico
- Kit de reagentes meio reacional
- Kit de reagentes para imunoensaio
- Kit de reagentes corante
- Kit de reagentes para citologia
- Kit de reagentes anticorpos
- Kit de reagentes solução tampão
- Reagente de química clínica
- Kit de reagentes de bactérias
- Kit de teste para pesquisa
* Os preços não incluem impostos, transporte, taxas alfandegárias, nem custos adicionais associados às opções de instalação e de ativação do serviço. Os preços são meramente indicativos e podem variar em função dos países, do custo das matérias-primas e das taxas de câmbio.