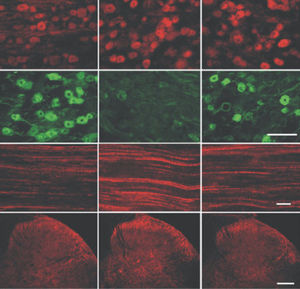
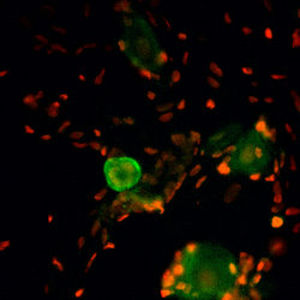
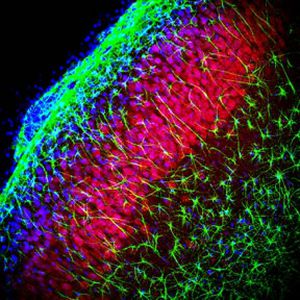
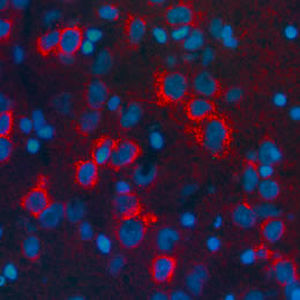
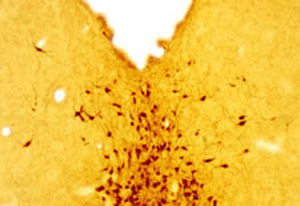
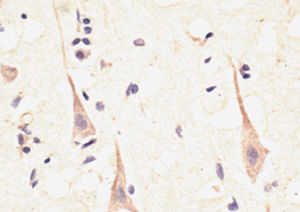
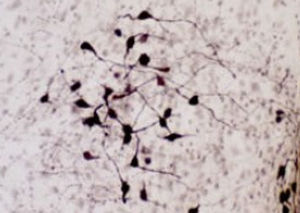
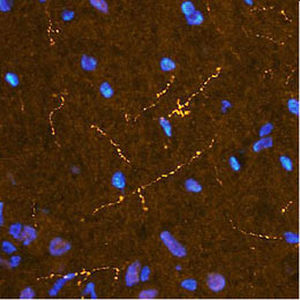
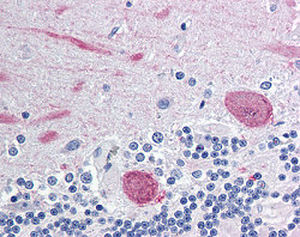
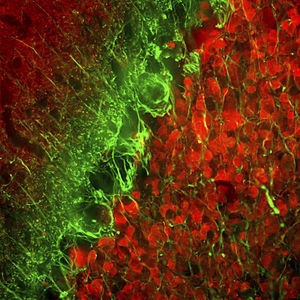
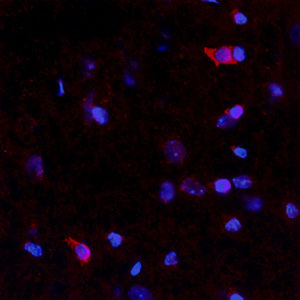
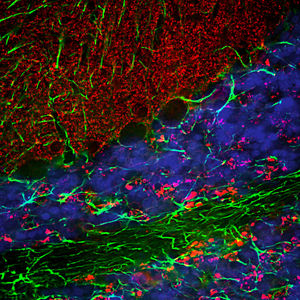
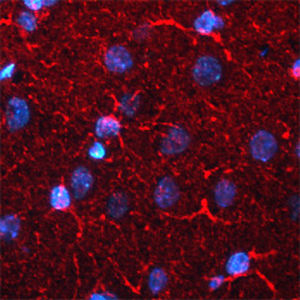
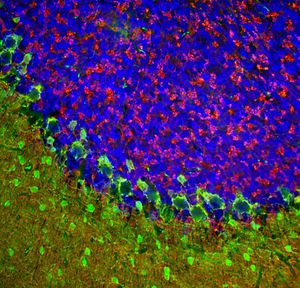
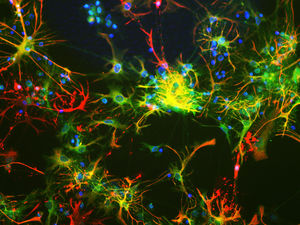
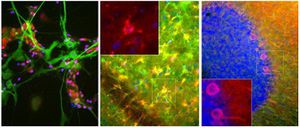
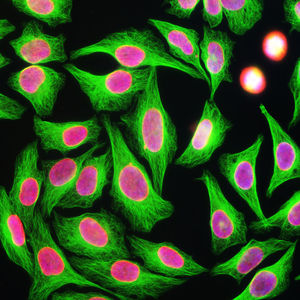
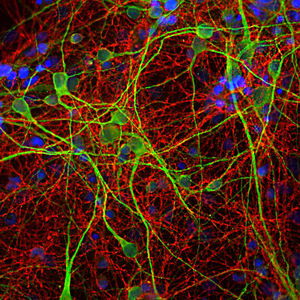
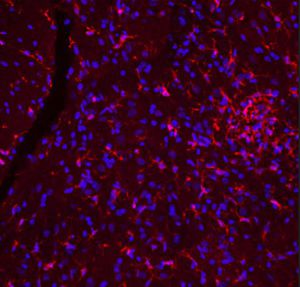
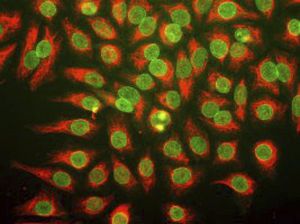
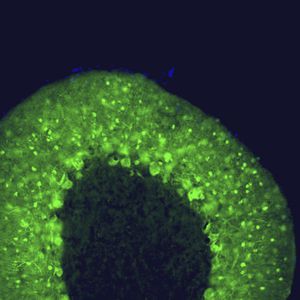
Reagente IgG MO22196para western blotpara imunofluorescênciapara imunocitoquímica
Guardar nos favoritos
Comparar
Características
- Tipo
- IgG
- Aplicações
- para western blot, para imunofluorescência, para imunocitoquímica
- Forma
- líquido
- Marcador testado
- PEA15
- Origem
- extraído de ratos
- Temperatura de armazenamento
MÁX: 4 °C
(39 °F)MÍN: -20 °C
(-4 °F)
Descrição
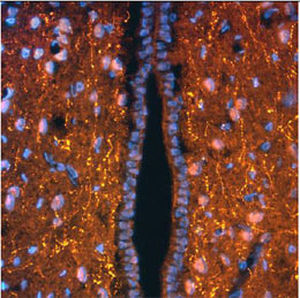
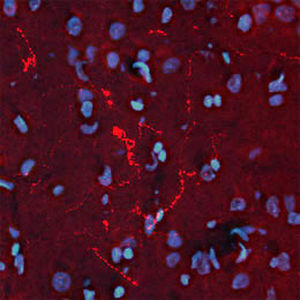
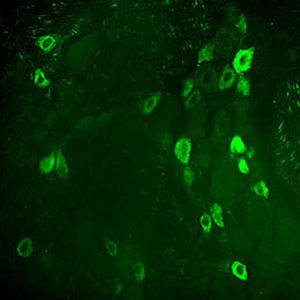
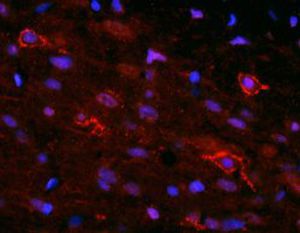
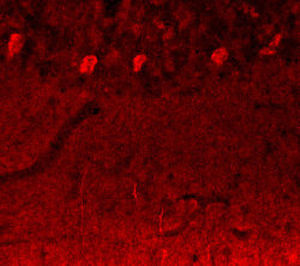
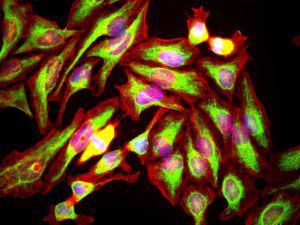
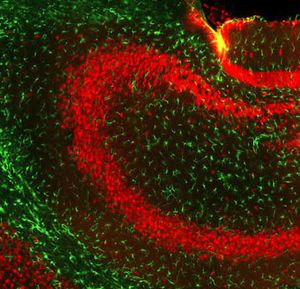
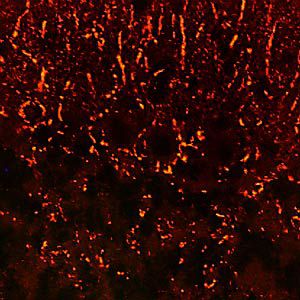
A PEA-15 foi originalmente isolada como uma proteína de baixo peso molecular importante de astrócitos estriatais embrionários de ratinho cultivados em cultura celular. Três manchas em géis 2D com um peso molecular aparente de 15kDa e ponto isoelétrico 5,1-5,3 demonstraram ser formas diferentes de uma proteína. A proteína foi serina fosforilada num local pela proteína quinase C, tanto in vivo como in vitro, e a proteína foi designada "fosfoproteína enriquecida em astrócitos de 15kDa", ou seja, PEA-15. A clonagem e sequenciação subsequentes revelaram uma proteína bem conservada em termos de sequência entre o rato e o ser humano e que era fortemente expressa no cérebro. Independentemente disso, verificou-se que a mesma proteína se encontrava sobre-expressa em fibroblastos e tecidos de doentes diabéticos, pelo que foi designada "proteína enriquecida na diabetes" ou PED. Estudos imunocitoquímicos mostraram que a proteína estava fortemente expressa nos astrócitos e em certos neurónios do SNC de ratinhos, embora esteja expressa em níveis mais baixos de forma ubíqua. Foi demonstrado que a PEA-15 interage com a quinase regulada por sinal extracelular e regula a entrada nuclear desta proteína, tendo sido descritas várias outras interacções importantes com outras proteínas envolvidas na regulação da apoptose, do metabolismo da glicose e do crescimento celular. O MCA-4D2 foi produzido contra uma construção recombinante de PEA-15 de comprimento total expressa e purificada a partir de E. coli.
---
Catálogos
Não estão disponíveis catálogos para este produto.
Ver todos os catálogos da NeuromicsPesquisas relacionadas
- Kit de reagentes
- Kit de reagentes para biologia molecular
- Kit de reagentes líquido
- Kit de reagentes para pesquisa
- Software de análise
- Kit de reagentes de proteínas
- Kit de reagentes para imunoensaio
- Kit de reagentes anticorpos
- Software de laboratório
- Kit de reagentes liofilizado
- Kit de reagentes de soro
- Kit de reagentes para imunohistoquímica
- Kit de reagentes para enzimas
- Kit de reagentes anticorpo monoclonal
- Kit de reagentes para western blot
- Reagente para pesquisa científica
- Software para pesquisa
- Kit de reagentes para imunofluorescência
- Reagente anticorpo policlonal
- Kit de reagentes citocina
* Os preços não incluem impostos, transporte, taxas alfandegárias, nem custos adicionais associados às opções de instalação e de ativação do serviço. Os preços são meramente indicativos e podem variar em função dos países, do custo das matérias-primas e das taxas de câmbio.